باتری لیتیوم یونی (تلفظ صحیح لیتیوم-آیون است اما یون رایج شده است) یا Lithium-Ion Battery که به اختصار LIB هم گفته میشود، یکی از انواع باتری هستند که ساختار خاص خود را دارند ولیکن اصول کلی یک باتری را در این نوع خاص هم شاهد هستیم مثل استفاده از مادهی الکترولیت که قرار است یونها را بین دو قطب مثبت یا کاتد و منفی یا آند جابجا کند. مثلاً در نمونهی زیر دو الکترود و الکترودی از جنس نمک برای ذخیره کردن انرژی به کار رفته است:
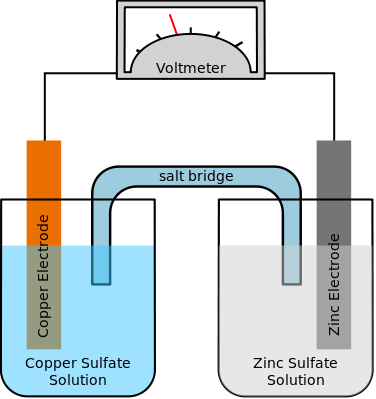
شارژ و دشارژ با حرکت یون لیتیوم ممکن میشود
در باتری لیتیوم یون، همانطور که نام باتری گویای آن است، این یونهای لیتیوم هستند که با جابجایی خود در الکترولیت، عمل شارژدهی یا شارژ شدن را ممکن میکنند. سر مثبت باتری از جنس آلومینیوم است و سر منفی از مس تشکیل میشود. وقتی باتری کاملاً دشارژ شده باشد، تمام یونهای لیتیوم در اطراف الکترود مثبت یا کاتد جمع شدهاند.
هنگام شارژ و دشارژ باتری، لیتیوم الکترون خود را به آند واگذار میکند و خودش به عنوان یون مثبت، به کاتد میپیوندد
همانطور که میدانید، لیتیوم از فلزات گروه یک جدول تناوبی است که به شدت با نافلزات واکنش میدهد. اگر طبق تئوری کلاسیک صبحت کنیم، یک الکترون لایهی آخر خود را در اختیار نافلزات قرار میدهد تا پیوندی یونی شکل بگیرد. در محیط الکترولیت هم اگر بازهی دشارژ را در نظر بگیریم، لیتیوم الکترون خود را به قطب منفی یا آند واگذار کرده و تبدیل به یونی با بار مثبت میشود. در ادامه بدون یک الکترون خود سراغ الکترود مثبت میرود. به عبارت سادهتر، خاصیت شیمیایی لیتیوم آن را به سمت قطب مثبت میکشاند. اما در هنگام شارژ اوضاع کاملاً برعکس میشود. به این معنی که الکترونها از قطب منفی وارد الکترولیت شده و به یونهای لیتیوم میپیوندند. لیتیومها که حالا خنثی شدهاند، دوباره به سمت قطب منفی کوچ میکنند تا مجدداً آمادهی تحویل الکترون و به عبارتی شارژدهی شوند.
جنس الکترود در باتری لیتیوم یون، متنوع است
معمولترین مادهای که به عنوان الکترود منفی ایفای نقش میکند، گرافیت است. ساختار صفحهای اتمهای کربن که آرایش شش ضلعی دارند و هادی الکتریسیته هستند. قطب مثبت یا کاتد هم معمولاً سه نوع دارد. اکسید لیتیوم کبالت یا اکسیدهای مشابه به صورت لایهای، پلیالکترولیتهایی مثل فسفات لیتیوم آهن و اسپینلهایی مثل اکسید لیتیوم منیزیم. تصویر زیر گویای همه چیز است. فرآیند شارژ به صورت خلاصه این است که یون لیتیوم با دریافت الکترون از آند، در کنار لایههای گرافیتی جا خوش کند.در هنگام دشارژ هم یک الکترون خود را مجدداً به لایههای گرافیکی قطب منفی واگذار کرده و اکسید لیتیوم کبالت شکل بگیرد. کبالت هم در این فرآیند، از حالت 4 بار مثبت به 3 بار مثبت تغییر میکند تا لیتیوم یک بار مثبت را کنار خود جای دهد:
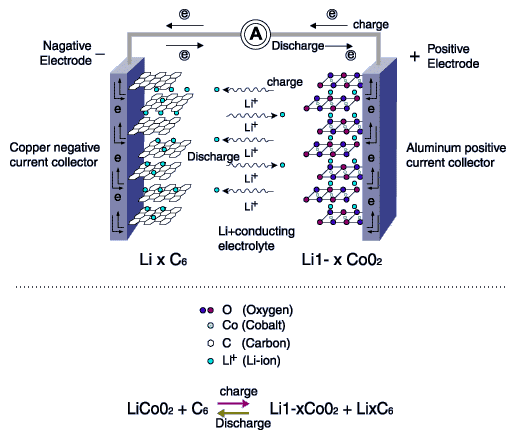
فرض کنید باتری کاملاً شارژ شده است. در این لحظه درون باتری مجموعهای از اتمهای لیتیوم را میبینیم که کنار قطب منفی قرار دارند و آمادهی واگذاری الکترون. در ابتدای فرآیند دشارژ با توجه به زیاد بودن اتمهای لیتیوم، ولتاژ بالاتر است و جریان به راحتی تأمین میشود. البته برای شروع دشارژ باید قطب مثبت و منفی باتری لیتیوم-یونی ما به هم پیوند بخورد. مستقیم یا غیر مستقیم، فرقی نمیکند، مهم این است که الکترولیت بخشی از چرخه را تشکیل داده تا الکترونها مسافرت خود را شروع کنند و بخش دیگر، اتصال قطب مثبت و منفی باتری در محیط بیرون است.




بدون دیدگاه